生命科学与技术学院黄志伟教授课题组揭示AcrIIA14蛋白抑制SauCas9的分子机制
哈工大全媒体(生命/文)6月9日,我校生命科学与技术学院黄志伟教授课题组在《核酸研究》(Nucleic Acids Research)上在线发表了题为《AcrIIA14抑制金黄色葡萄球菌Cas9的结构基础》的研究文章。该研究解析了Anti-CRISPR蛋白——AcrIIA14结合金黄色葡萄球菌Cas9(SauCas9)的高分辨率晶体结构,通过结构分析以及相应的生化实验,阐述了AcrIIA14蛋白特异性抑制SauCas9酶切活性的分子机制。该研究拓展了对Anti-CRISPR蛋白调控CRISPR-Cas系统活性的理解,对精确控制SauCas9以及其他CRISPR-Cas系统用于基因编辑应用提供了理论基础以及新的思路。
CRISPR-Cas系统因其便捷的操作性以及非常高的体内编辑效率,成为目前应用最为广泛的基因编辑工具。但在实际应用中还面临很多亟需解决的问题,其中一个重要的问题就是由于其不可控的剪切活性带来基因编辑的脱靶效应。如何给基因编辑系统装上刹车,控制其编辑活性一直是领域内尝试解决的问题。CRISPR-Cas系统作为细菌的适应性免疫系统用于噬菌体入侵,面对细菌的CRISPR-Cas的选择压力,噬菌体进化出了相对应的拮抗机制,即噬菌体进化出Anti-CRISPR蛋白抑制细菌CRISPR-Cas系统的活性。在之前的研究中,发现Anti-CRISPR蛋白AcrIIA14能够抑制SauCas9的活性,但具体的分子机制并不清楚。
在本研究中,首先在体外纯化组装得到了稳定的AcrIIA14结合SauCas9-sgRNA-dsDNA的四元复合物蛋白,然后运用X射线晶体学的方法解析了该复合物的晶体结构。通过分析该复合物结构,发现AcrIIA14蛋白以1:1的化学计量比与SauCas9蛋白的HNH结构域相互作用。AcrIIA14蛋白通过结合HNH核酸酶结构域,使其发生构象变化,这种HNH的构象变化导致其活性位点远离结合靶DNA的位置,从而抑制SauCas9的激活。此外,通过结构比较还发现AcrIIA14蛋白的结合,诱导了SauCas9中的HNH结构域和L1 linker发生了变构,从而导致产生了两个新的分子内的相互作用界面。结合生化实验发现,AcrIIA14诱导产生的SauCas9的变构起到了增强抑制效果的作用。这种引起Cas9蛋白变构的效果,与以往发现的另外两种同样结合在HNH结构域的抑制蛋白AcrIIC1和AcrIIC3的抑制机制有所不同,表现出Anti-CRISPR蛋白抑制SauCas9机制的多样性。
生命科学与技术学院博士生刘虹男、副研究员朱玉威为该论文的并列第一作者;黄志伟为本研究论文的通讯作者;硕士研究生卢泽彬参与该研究的部分工作。本研究的晶体衍射数据在上海光源BL17U收集。本项目受到国家自然科学基金委基金的资助。
文章链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab487/6295537
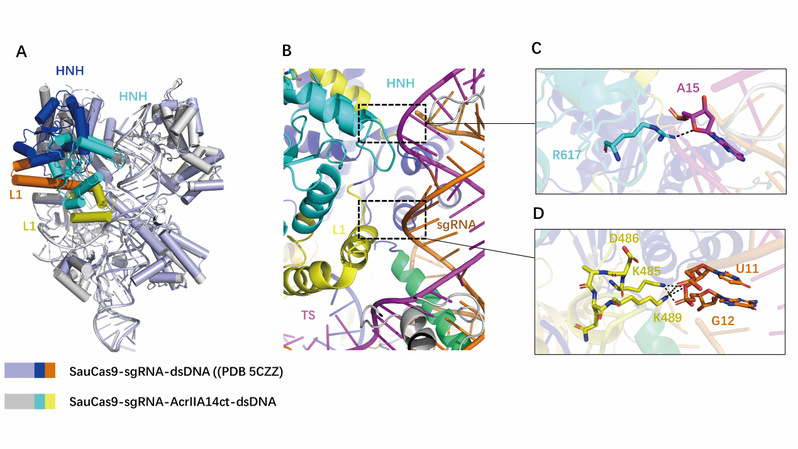
AcrIIA14诱导SauCas9变构








