生命学院田维明课题组揭示Krüppel样转录因子7(Klf7)调控心脏糖脂代谢平衡参与心肌肥厚发病新机制
哈工大全媒体(赵玉芳 文/图)近日,生命学院田维明课题组研究揭示了Krüppel样转录因子7(Klf7)调控心脏糖脂代谢平衡参与心肌肥厚发病的新机制。研究成果以《Klf7/Pfkl/Acadl轴调控雄性小鼠心肌肥厚期间的代谢重塑》(The Klf7/Pfkl/Acadl axis modulates cardiac metabolic remodelling during cardiac hypertrophy in male mice)为题发表在《自然通讯》(Nature Communications)上。该研究阐明Klf7/Pfkl/Acadl轴为调节肥厚和衰竭心脏代谢平衡提供潜在的治疗靶点。
心肌底物利用偏好在整个生命周期及生理和病理条件下均会发生相应变化。胎儿时期,心脏高度依赖糖酵解作为三磷酸腺苷(ATP)供能的主要途径,到成年阶段,脂肪酸氧化则发挥主要作用。心肌底物利用偏好从脂肪酸氧化转换为糖酵解,代谢逐渐向胚胎方式转化是心肌肥厚向心力衰竭发展的重要标志。然而,糖酵解与脂肪酸氧化之间的密切关系及引起心脏病理重构的潜在机制尚不清楚。本研究旨在揭示调控脂肪酸和葡萄糖代谢的转录调控机制,可为心肌肥厚和心力衰竭治疗提供基于调控糖脂代谢紊乱的治疗靶点。
在心肌肥厚和心力衰竭阶段,糖脂代谢底物的转换是一种代偿性现象还是重要致病因素,几十年来一直存在争议,本研究证实糖脂代谢底物的转换是引发心肌肥厚的独立因素。研究发现,Klf7心肌特异性敲除(KO)小鼠和Klf7心肌特异性过表达(TG)小鼠分别干扰成年和幼年时期心脏的糖脂代谢平衡,导致其心脏收缩功能障碍和心肌纤维化产生。因此,KO和TG小鼠均可作为自发性心肌肥厚模型,为研究幼年到成年阶段代谢疾病的病理进展提供基础。最终,团队通过体内和体外实验,证明心肌特异性敲低磷酸果糖激酶(Pfkl)和过表达长链酰基辅酶A脱氢酶(Acadl)分别通过抑制糖酵解和增强脂肪酸氧化来部分缓解KO小鼠的心肌肥厚病理表型。
我校生命学院田维明教授为论文通讯作者。生命学院博士研究生王操为论文第一作者,哈尔滨医科大学乔书培博士为论文并列第一作者。我校空间基础科学研究中心赵玉芳副研究员,哈尔滨医科大学附属第一医院闫威副主任医师,哈尔滨医科大学附属第四医院侯小路副主任医师,田维明课题组博士研究生田辉、王瑞琦、张博淞、杨超凡、祝富星、陈悦,硕士研究生矫彦文、金家名参与论文研究工作。
本研究获得国家重点研发项目、国家自然科学基金和黑龙江省头雁团队原创探索基金的支持。
论文链接:https://www.nature.com/articles/s41467-023-36712-9
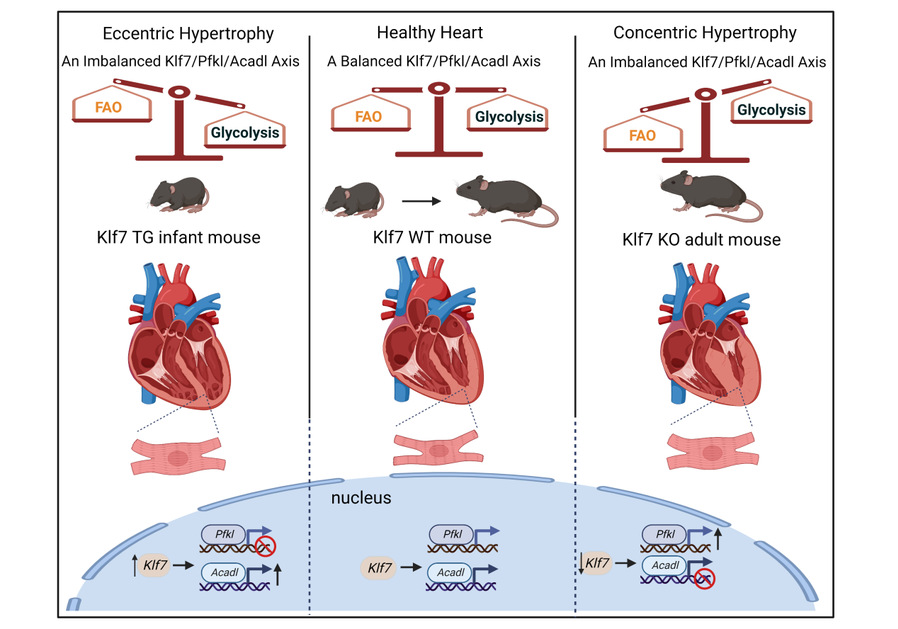
Klf7/Pfkl/Acadl轴调控心肌代谢平衡参与心肌肥厚模式图








