生命学院黄志伟教授课题组在CRISPR-Cas领域取得新成果
哈工大报讯(生命/文)近日,我校生命学院黄志伟教授课题组通过冷冻电镜和生化研究手段揭示了III型CRISPR-Cas系统的Csm复合体的近原子分辨率的结构以及其通过DNA和RNA核酸酶活性分别剪切RNA、DNA底物的分子机制。研究成果以“通过冷冻电镜和生化实验揭示三型CRISPR-Cas系统Csm复合物的DNase和RNase酶活性偶联机制”(Coupling of ssRNA cleavage with DNase activity in type III-A CRISPR-Csm revealed by cryo-EM and biochemistry)为题,于2月27日发表在《细胞研究》(Cell Research)杂志上。
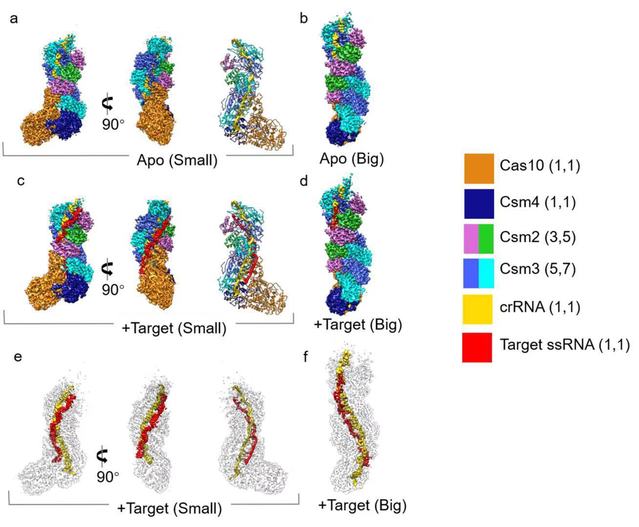
CRISPR/Cas系统是细菌和古细菌抵御外源入侵的一种适应性免疫机制。该系统通过剪切噬菌体的DNA或RNA从而防御噬菌体的入侵。III型 CRISPR-Cas系统分为III-A亚型和III-B亚型,III-A亚型称为Csm效应复合物,III-B亚型称为Cmr效应复合物,III-A亚型Csm复合物由5个Cas蛋白(Cas10、Csm2-5)和crRNA组成。为认识III-A亚型CRISPR/Cas系统降解单链DNA和RNA的分子机制,课题组解析了嗜热链球菌(Streptococcus thermophilus)III-A亚型 Csm复合物和Csm复合物与底物ssRNA的近原子分辨率的冷冻电镜结构,结合生物化学实验方法揭示了Csm复合物剪切DNA和RNA的分子机制,并提出Csm复合物的DNase和RNase酶活性偶联机制的模型。该研究发现底物ssRNA的3’端侧翼序列对激活Csm的DNase和RNase活性非常关键,它和Cas10接触通过別构调节从而剪切非特异性的单链DNA,当ssRNA与Csm复合物结合时激活该复合物剪切ssRNA和单链DNA,接着ssRNA被Csm复合物在远离3’端侧翼序列的位置剪切并从复合物解离,从而使得复合物降解DNA的活性失活。这种在一定时间窗口期激活DNase的方式,使得细菌利用该免疫系统可以有效防御噬菌体的入侵,同时也避免长时间激活DNase导致非特异剪切自身DNA。
黄志伟教授和美国斯坦福大学赵华(Wah Chiu)教授为研究论文的通讯作者,我校博士研究生郭明慧和斯坦福大学博士后张开明(Kaiming Zhang)为该论文的并列第一作者。本项目受到国家自然科学基金委、哈工大青年科学家工作室等基金的资助。
文章链接:https://www.nature.com/articles/s41422-019-0151-x